Temat statutowy 1.04
Tytuł tematu: Charakterystyka endofitów bakteryjnych wyizolowanych z wybranych roślin miododajnych oraz określenie ich potencjału biotechnologicznego
Kierownik tematu: dr Anna Marzec-Grządziel
Okres realizacji: 2022-2024
Cel badań:
Celem badań będzie izolacja bakterii endofitycznych z różnych części wybranych roślin miododajnych, identyfikacja genetyczna izolatów, charakterystyka metaboliczna wybranych izolatów, charakterystyka pod kątem występowania cech biochemicznych promujących wzrost roślin, ocena wpływu wybranych izolatów na wzrost gospodarza rodzimego w teście na skalę laboratoryjną. Dodatkowym aspektem będzie charakterystyka funkcjonalna i strukturalna mikroorganizmów (bakterii) w glebie ryzosferowej analizowanych roślin. Badania będą próbą wyodrębnienia izolatów bakteryjnych o wysokim potencjale aplikacyjnym i biotechnologicznym. Badania zostaną przeprowadzone w latach 2022-2024. Materiał do badań będą stanowiły próby roślin (Facelia błękitna, Phacelia tanacetifolia Benth.; Nawłoć pospolita, Solidago virgaurea L.; Gryka zwyczajna, Fagopyrum esculentum Moench; Żmijowiec zwyczajny, Echium vulgare L.; Ogórecznik lekarski, Borago officinalis L.) oraz gleby pobrane z terenów uprawnych lub trwałych użytków zielonych (wybrane gospodarstwa rolne).
Planowane efekty naukowe:
Uzyskane wyniki badań będą stanowiły dogłębną wiedzę na temat charakterystyki genetycznej oraz fenotypowej bakterii endofitycznych wybranych roślin miododajnych. Zastosowanie najnowszych i zaawansowanych metod analizy (NGS, Biolog) umożliwi przedstawienie uzyskanych wyników w interesującej formie. Odbiorcami wyników będą naukowcy z całego świata zajmujący się tematyką endofitów roślinnych. Jednocześnie, wyniki mogą być podłożem do złożenia wniosku projektowego o charakterze aplikacyjnym lub wdrożeniowym.
Zespół badawczy:
- dr Anna Marzec-Grządziel;
- dr hab. Anna Gałązka, prof. IUNG;
- dr Grażyna Korbecka-Glinka;
- dr Marcin Przybyś.
2022
Pobrano po 5 prób każdej z roślin (Facelia błękitna, Phacelia tanacetifolia Benth.; Żmijowiec zwyczajny, Echium vulgare L.; Dziurawiec zwyczajny, Hypericum perforatum L). Rośliny podzielono na 3 części (korzeń, łodyga, liść), wykonano próbkę zbiorczą, którą poddano procesowi sterylizacji powierzchniowej. W celu określenia skuteczności procesu sterylizacji ostatnia woda po płukaniu wykorzystana została w reakcji PCR oraz rt-PCR w celu sprawdzenia ewentualnej obecności DNA bakterii.
Z części roślin przygotowano 20% homogenaty w jałowej soli fizjologicznej (0.85%), które wykorzystano do analizy BIOLOG oraz izolacji DNA.
Reakcję qPCR przeprowadzono w celu określenia liczby kopii genu 16S rRNA w próbkach. Najwięcej kopii wykazano w próbkach pochodzących z facelii, najmniej natomiast z dziurawca.
Jednocześnie uzyskane homogenaty wykorzystano do izolacji bakterii endofitycznych na podłożach stałych. Uzyskane bakterie przeszczepiano na nowe szalki z podłożem, do uzyskania czystych kultur bakteryjnych. Czyste kultury przechowywano w postaci skosów oraz liofilizatów. W ten sposób uzyskano 32 szczepy bakteryjne (Facelia błękitna – 8 szczepów; Żmijowiec zwyczajny – 12 szczepów; Dziurawiec zwyczajny – 12 szczepów).

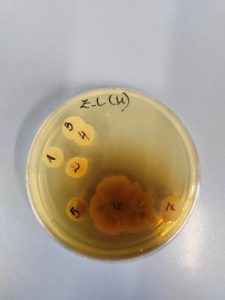
Z analizowanych szczepów na szalkach przygotowano materiał do PCR kolonijnego. Uzyskena DNA wykorzystano do różnicowania szczepów pod względem genetycznym (BOX – PCR, ERIC – PCR, RAPD – PCR).
Uzyskano następujące wyniki:
| Nr | Szczep | Przypisany rodzaj | Najbliższe pokrewieństwo | % pokrycia | % podobieństwa |
| 21 | D_K_2 | Pseudomonas | P. poae | 100 | 100 |
| 22 | D_K_3 | Bacillus | – | 100 | 100 |
| 1 | D_Ł_1 | Bacillus | B. tropicus | 100 | 99.6 |
| 2 | D_Ł_2 | Pantoea | P. agglomerans | 100 | 99.3 |
| 3 | D_Ł_3 | Paenibacillus | – | 100 | 99.5 |
| 4 | D_L_1 | Bacillus | – | 100 | 100 |
| 5 | D_L_2 | Bacillus | – | 100 | 100 |
| 23 | D_L_3 | Bacillus | – | 100 | 100 |
| 7 | D_L_4 | Paenibacillus | P. xylanexedens | 100 | 99.4 |
| 8 | D_L_5 | Bacillus | B. licheniformis | 100 | 100 |
| 9 | D_L_6 | Bacillus | B. altitudinis | 100 | 100 |
| 24 | Ż_K_1 | Pseudomonas | – | 100 | 99.9 |
| 25 | Ż_K_2 | Pseudomonas | P. fluorescens | 100 | 100 |
| 26 | Ż_Ł_1 | Pseudomonas | – | 100 | 99.9 |
| 11 | Ż_L_1 | Frigoribacterium | – | 100 | 99.9 |
| 12 | Ż_L_2 | Bacillus | – | 100 | 99.9 |
| 13 | Ż_L_3 | Pseudomonas | P. fluorescens | 100 | 100 |
| 14 | Ż_L_4 | Priestia | P. aryabhattai | 100 | 100 |
| 15 | Ż_L_5 | Peribacillus | P. frigoritolerans | 100 | 100 |
| 16 | Ż_L_6 | Priestia | P. aryabhattai | 100 | 100 |
| 17 | Ż_L_7 | Bacillus | – | 100 | 100 |
| 27 | F_K_1 | Pseudomonas | P. koreensis | 100 | 99.9 |
| 28 | F_K_2 | Pseudomonas | – | 100 | 100 |
| 29 | F_K_3 | Pseudomonas | – | 100 | 100 |
| 18 | F_Ł_2 | Priestia | P. aryabhattai | 100 | 100 |
| 19 | F_L_1 | Bacillus | B. mycoides | 100 | 100 |
| 30 | F_L_2 | Erwinia | – | 100 | 100 |
| 20 | F_L_3 | Peribacillus | P. frigoritolerans | 100 | 100 |